
国外标准情况简介
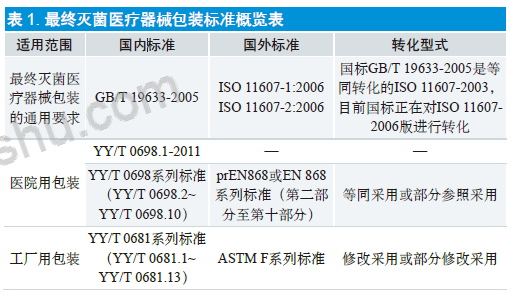
1992 年以来,欧洲标准化委员会(CEN)和国际标准化组织委员会(ISO)就开始致力于灭菌包装的全球统一标准工作。1997 年ISO/TC198(卫生保健灭菌技术委员会)制定了ISO 11607:1997《最终灭菌医疗器械包装》。1997 年2 月欧洲标准委员会CEN/TC102 发布了EN 868-1:1997《待灭菌医疗器械包装材料和系统第一部分:一般要求和试验方法》,自此以后至1999 年先后发表了EN 868-2 至EN 868-10 等一系列标准和试验方法。随着医疗器械行业的不断发展,原有的标准也在不断地升级完善。2006 年上半年发布的新版ISO 11607[1,2] 包括两个部分,《最终灭菌医疗器械的包装 第1 部分:材料、无菌屏障系统和包装系统的要求》和《最终灭菌医疗器械的包装 第2 部分:成型、密封和装配过程的确认要求》。这两部分实现了ISO 和CEN 标准的统一,同时废止了EN 868-1,保留了EN 868-2 至EN 868-10 的部分并进行了部分修改。这一系列标准规定了包装常用材料的专用要求,可用来证实符合ISO 11607-1中规定的一个或多个要求,为具体包装材料和预成形无菌屏障系统的确定提供指导。
ISO 11607-1 是最终灭菌医疗器械包装系统的“通用要求”,而EN 868 系列标准则是ISO 认可的“专用要求”。[3]ISO 11607 标准和EN 868 系列标准是国际上公认的涉及最终灭菌医疗器械包装的系列标准,这些标准已经被美国、欧洲和其他地区采用。

PAKION 塑塑平面袋 帕克医疗供应
2.国内标准情况简介
我国已将ISO 11607-2003《最终灭菌医疗器械的包装》等同采用,转化为国家标准,并于2005 年1 月24 日发布GB/T 19633-2005《最终灭菌医疗器械的包装》,2005 年5 月1 日实施。现正将ISO 11607-1:2006《最终灭菌医疗器械的包装 第1 部分:材料、无菌屏障系统和包装系统的要求》和ISO 11607-2:2006《最终灭菌医疗器械的包装 第2 部分:成型、密封和装配过程的确认要求》转化为我国国家标准,目前正在转化之中。prEN 868 或EN 868 系列标准(第二部分至第十部分)我国等同采用或部分参照采用,已转化为YY/T 0698.2 至YY/T 0698.10 一系列行业标准,规定了最终灭菌医疗器械包装材料的检验方法及具体要求。
在ISO 11607-1:2006[1] 的附录B 中,给出了34 种可能被用于构成“包装材料和预成形无菌屏障系统”的材料或该系统本身的功能性实验的测试参考标准,主要为ISO、EN 和ASTM 等,这些标准都是医疗器械灭菌包装设计和验证实际工作经常被用到的。对于包装的专用试验方法, 我国以转化ASTM 系列标准为主。现已修改采用ASTMF 1980-02、ASTM F 88-06、ASTM F 1140-07、ASTM F 1929-98、ASTM F 2096-04、ASTM F 2250-03、ASTM F 2252-03、ASTM F 2217-02、ASTM F 2054-00 和ASTM F 1608-00,分别对应于我国行业标准YY/T 0681.1 至YY/T 0681.10。ASTM F 1886-98 等三个标准也对应转化为YY/T 0681.11、YY/T 0681.12 和YY/T 0681.13, 于2014 年6 月17 日予以公布,将于2015 年7 月1日起实施。
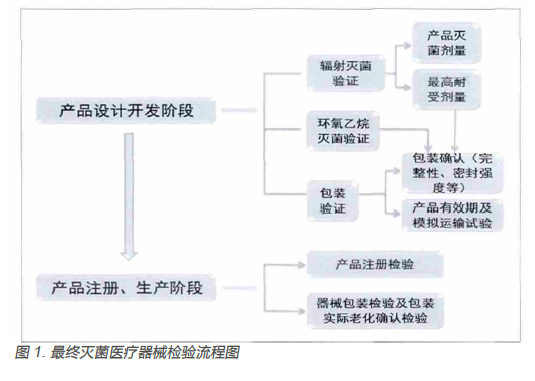
3.对最终灭菌医疗器械包装检验的建议
结合医疗器械注册与备案管理办法等相关规定要求,最终灭菌医疗器械在“产品设计开发阶段”需要进行关键工序和特殊过程研究、产品有效期和包装研究等。企业可根据设计开发的产品标准,灭菌/ 消毒工艺验证、产品有效期及包装确认等标准的具体要求,委托有相关资质的检验机构进行验证。下图为根据最终灭菌医疗器械包装检验标准及实际检验经验绘制的检验流程图,企业可以依据此流程图完成各阶段的验证工作。
帕克医疗为您提供专业的无菌医疗器械包装生产、封口设备方案以及第三方灭菌方案推介。
转载自:爱学术《最终灭菌医疗器械包装标准体系简介》
声明:本文内容部分来源于网络,仅供交流学习,不做商用,若有来源标注存在错误或侵犯到您的权益,烦请告知,我司将于第一时间整改处理